Actualizado: 13 may. 2025
Qué es el amónico y para qué sirve
Este artículo explora en profundidad qué es el amoníaco, cómo se produce, para qué sirve y sus principales usos industriales. También analizamos los riesgos y peligros asociados a su manipulación y el impacto ambiental que conlleva su producción y uso.
16 min lectura
Autor - Aldo Venuta Rodríguez
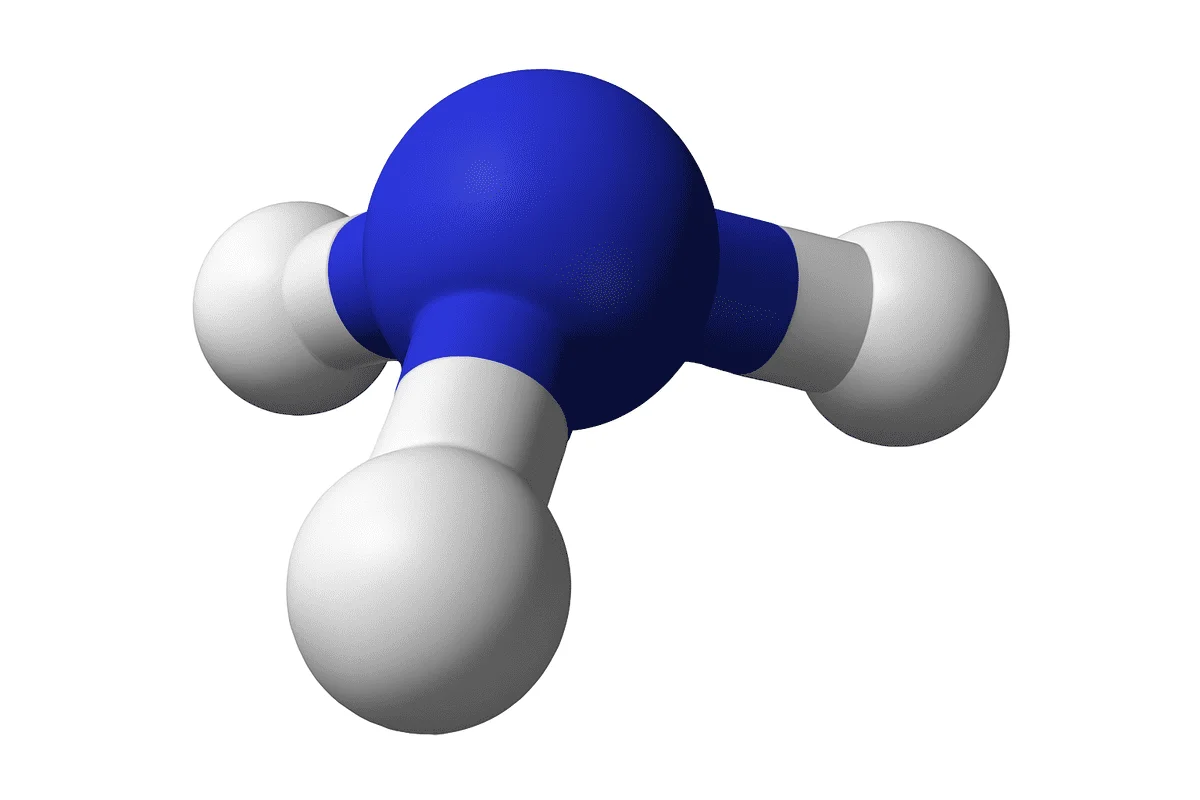
¿Qué es el amoníaco?
El amoníaco es un compuesto químico formado por nitrógeno e hidrógeno, con la fórmula molecular NH3. En condiciones normales es un gas incoloro de olor muy penetrante e intenso, conocido por su aroma característico a “orina” o productos de limpieza con amoníaco.
Es altamente soluble en agua, formando soluciones acuosas (como el amoníaco doméstico usado en limpieza) que desprenden vapores irritantes. En forma pura y sin agua (llamado amoníaco anhidro), puede licuarse a presión moderada o a baja temperatura, almacenándose como líquido en tanques presurizados.
Químicamente, el amoníaco es una base alcalina y reacciona con ácidos para formar sales de amonio. Es uno de los productos químicos más importantes a nivel industrial. De hecho, el amoníaco figura entre las sustancias de mayor producción mundial cada año.
Su relevancia radica principalmente en que es la fuente de nitrógeno para la fabricación de fertilizantes y otros compuestos nitrogenados esenciales. Sin el amoníaco, la agricultura moderna no podría sostener los niveles actuales de producción de alimentos, ya que no habría suficiente nitrógeno utilizable para las plantas.

¿Cómo se produce el amoníaco?
La producción industrial de amoníaco se realiza principalmente mediante el proceso Haber-Bosch, desarrollado a inicios del siglo XX. En este proceso, el nitrógeno del aire (N2) se combina con hidrógeno (H2) en condiciones de alta presión (alrededor de 150-200 atmósferas) y alta temperatura (unos 400-500 °C) en presencia de un catalizador (generalmente hierro con promotores). La reacción química principal es:
N2 + 3 H2 → 2 NH3
Esta síntesis directa del nitrógeno y el hidrógeno es exotérmica (libera energía) y, a pesar de parecer sencilla, requiere las condiciones extremas mencionadas para lograr una conversión eficiente, ya que el nitrógeno molecular es muy estable e inerte. El proceso Haber-Bosch revolucionó la industria química y la agricultura, pues permitió la fabricación masiva de amoníaco y, con ello, de fertilizantes nitrogenados, impulsando el crecimiento de la producción de alimentos a escala mundial.
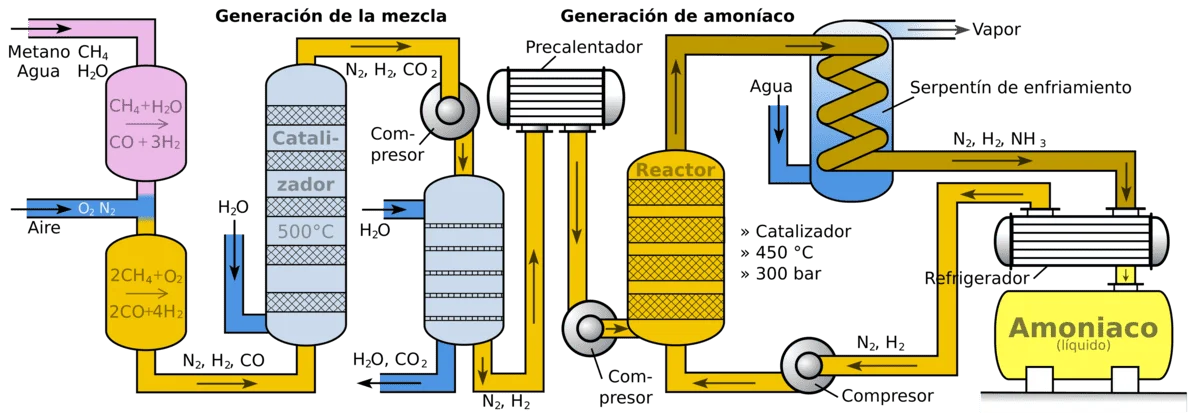
Para obtener el hidrógeno necesario en la síntesis, tradicionalmente se emplean combustibles fósiles como fuente. La ruta más común es a través del gas natural (principalmente metano, CH4), que se reforma con vapor de agua en un proceso llamado reformado con vapor para generar hidrógeno (H2) y monóxido de carbono (CO).
Alternativamente, en algunas plantas se utiliza la gasificación del carbón o incluso derivados del petróleo pesado para producir el gas de síntesis (mezcla de H2 y N2) necesario. Sin embargo, alrededor del 75–80% del amoníaco mundial se produce a partir de gas natural, por ser la ruta más eficiente y económica actualmente.
Una vez obtenido el hidrógeno, se purifica y se mezcla con nitrógeno (extraído del aire mediante procesos de separación de gases). Esta mezcla 3:1 de H2 y N2 se introduce en el reactor Haber-Bosch. Tras la reacción, el gas resultante contiene amoníaco junto con los reactivos no convertidos; al enfriarse, el amoníaco se licúa y se separa, mientras que el nitrógeno y el hidrógeno no reaccionados se reciclan de nuevo al reactor. Así se logra un proceso continuo y eficiente.
Si bien el proceso convencional consume mucha energía y emite dióxido de carbono (CO2) debido al uso de combustibles fósiles, en años recientes ha cobrado interés la producción de amoníaco “verde”. Este amoníaco ecológico se obtendría utilizando hidrógeno generado por energías renovables (por ejemplo, por electrólisis del agua usando electricidad solar o eólica, conocido como hidrógeno verde).
Al eliminar el gas natural o el carbón como insumos, se reducirían drásticamente las emisiones de CO2 asociadas. Así, el amoníaco podría convertirse en un vector energético limpio, ya que además de fertilizante, también se estudia su uso como combustible libre de carbono (al quemarlo genera agua y nitrógeno, pero no CO2). No obstante, estas tecnologías aún están en desarrollo y hoy en día la gran mayoría del amoníaco se sigue produciendo mediante procesos tradicionales.
¿Para qué sirve el amoníaco?
El amoníaco tiene una enorme variedad de aplicaciones, pero su uso primordial y con diferencia es como base para fabricar fertilizantes. Aproximadamente un 90% del amoníaco producido a nivel mundial se destina a la agricultura, ya sea aplicado directamente al suelo en forma de amoníaco anhidro o, más comúnmente, convertido en fertilizantes nitrogenados como la urea (CO(NH2)2), el nitrato de amonio (NH4NO3) o fosfatos de amonio.
Estos fertilizantes aportan nitrógeno esencial para el crecimiento de los cultivos, aumentando significativamente los rendimientos agrícolas. Gracias a los fertilizantes basados en amoníaco, fue posible soportar la expansión demográfica del siglo XX al incrementar la producción de alimentos a gran escala.
No obstante, fuera del ámbito agrícola, el amoníaco también sirve para múltiples propósitos industriales y comerciales. Por ejemplo, es un refrigerante muy eficaz: el amoníaco líquido (denominado R-717 en refrigeración) se emplea en sistemas de refrigeración industrial y en grandes cámaras frigoríficas, como las usadas en plantas de alimentos y bebidas.
Su capacidad de absorción de calor al evaporarse es alta, lo que lo hace ideal para enfriar grandes volúmenes; de hecho, antes de la llegada de los refrigerantes sintéticos, el amoníaco era común incluso en refrigeradores domésticos.
En el hogar, soluciones de amoníaco en agua (generalmente diluido al 5–10%) se utilizan como productos de limpieza, sobre todo para limpiar vidrios, azulejos y superficies debido a su poder desengrasante y desinfectante. Seguramente muchos conocen el “olor a amoníaco” de ciertos limpiadores multiusos. También tiene aplicaciones en la industria textil y de cuero para el tratamiento de materiales, y en la fabricación de productos de cuidado personal (por ejemplo, como alcalinizante en tintes para el cabello).
Otro uso importante del amoníaco es como materia prima en la industria química. A partir de él se producen una gran cantidad de compuestos. Un caso destacado es la obtención de ácido nítrico (HNO3) mediante el proceso Ostwald, en el cual el amoníaco se oxida a óxidos de nitrógeno que luego llevan a ácido nítrico. El ácido nítrico, a su vez, es precursor de fertilizantes (nitratos) y de explosivos (como el TNT y otros). Por tanto, el amoníaco está indirectamente presente en la fabricación de explosivos comerciales y militares.
Asimismo, el amoníaco interviene en la elaboración de plásticos y fibras sintéticas. Por ejemplo, es clave en la producción de nylon y otras poliamidas, ya que a partir del amoníaco se obtienen moléculas como el adiponitrilo y el hexametilenodiamina, esenciales para estas polímeros.
En la industria farmacéutica también se emplean derivados del amoníaco para sintetizar principios activos de medicamentos. Incluso se utiliza en el tratamiento de aguas (mediante la cloraminación, donde el amoníaco reacciona con el cloro para formar cloraminas que desinfectan el agua potable).
Usos del amoníaco en la industria
Como hemos visto, el amoníaco tiene aplicaciones sumamente diversas. En el entorno industrial, se aprovechan sus propiedades químicas y físicas en múltiples sectores. A continuación, se detallan algunos de los usos industriales más relevantes del amoníaco:
Agricultura y producción de fertilizantes
La industria de fertilizantes es, sin duda, la principal usuaria de amoníaco. Grandes instalaciones industriales convierten el amoníaco anhidro en fertilizantes nitrogenados granulados, como urea, nitrato de amonio, sulfato de amonio y fosfato de amonio mono y di-amónico (MAP y DAP).
Estas fábricas químicas mezclan el amoníaco con otros componentes (como CO2 para la urea, o ácido fosfórico para los fosfatos de amonio) y generan productos fertilizantes listos para su distribución a los agricultores. Además, en algunas regiones agrícolas se almacena amoníaco anhidro en tanques y se inyecta directamente al subsuelo como fertilizante; esta práctica es común en países con agricultura extensiva de maíz y cereales.
Industria química y petroquímica
El amoníaco es un insumo básico para muchas síntesis químicas. En plantas petroquímicas, se utiliza amoníaco para producir aminas orgánicas (combinando amoníaco con compuestos orgánicos), que luego se usan en productos como detergentes, cosméticos y aditivos.
También se emplea en la producción de resinas sintéticas y plásticos, en procesos de neutralización de ácidos y como catalizador o agente reductor en ciertas reacciones. En refinerías de petróleo y plantas de tratamiento de gas, el amoníaco se usa a veces para eliminar impurezas ácidas (como CO2 o H2S) mediante procesos de absorción química.
Refrigeración y climatización industrial
El uso del amoníaco como refrigerante industrial sigue vigente debido a su gran eficiencia térmica. Instalaciones como fábricas de hielo, plantas procesadoras de carne, cervecerías y patinódromos utilizan sistemas de refrigeración por amoníaco para mantener bajas temperaturas en amplios espacios.
Estos sistemas bombean amoníaco líquido a través de una red de tuberías; al evaporarse dentro de intercambiadores de calor, extrae el calor del ambiente circundante. A pesar de su toxicidad, el amoníaco es apreciado en refrigeración industrial porque es barato, no daña la capa de ozono y no contribuye significativamente al efecto invernadero (a diferencia de algunos refrigerantes sintéticos).
Control de emisiones y otras aplicaciones
En el sector energético, el amoníaco se usa en sistemas de reducción catalítica selectiva (SCR) para controlar la contaminación del aire. En centrales térmicas y calderas industriales, se inyecta amoníaco o urea en los gases de combustión para eliminar los óxidos de nitrógeno (NOX), transformándolos en nitrógeno y agua y reduciendo así la contaminación atmosférica.
Por último, cabe mencionar que el amoníaco está siendo investigado como combustible alternativo y medio de almacenamiento de energía. Por ejemplo, en el transporte marítimo se evalúa su uso en motores adaptados, ya que al no contener carbono, su combustión no produce CO2. Estas aplicaciones energéticas podrían cobrar relevancia en el futuro si se logra producir amoníaco de forma sostenible a gran escala.
Riesgos y peligros del amoníaco
A pesar de su gran utilidad, el amoníaco conlleva riesgos significativos para la salud y la seguridad si no se maneja adecuadamente. En primer lugar, es una sustancia tóxica e irritante. La inhalación de amoníaco gaseoso en concentraciones elevadas provoca irritación severa de las vías respiratorias, sensación de ahogo, tos intensa e incluso edema pulmonar potencialmente mortal.
Los ojos también son muy sensibles: la exposición provoca lagrimeo, ardor e incluso lesiones corneales que pueden conducir a ceguera temporal o permanente. El contacto del amoníaco líquido (o de soluciones concentradas) con la piel causa quemaduras químicas, ya que el amoníaco es corrosivo y además “roba” la humedad de los tejidos, pudiendo producir congelación por su rápida evaporación.
Por estas razones, en entornos industriales el personal que trabaja con amoníaco debe usar equipo de protección personal: mascarillas o respiradores con filtros adecuados, gafas protectoras, guantes y trajes resistentes a químicos.Cualquier fuga o derrame de amoníaco se considera una emergencia: las instalaciones con grandes cantidades suelen contar con alarmas y sistemas de ventilación forzada para disipar rápidamente el gas en caso de escape. El amoníaco es más ligero que el aire, por lo que tiende a ascender y dispersarse, pero en espacios confinados puede alcanzar concentraciones peligrosas muy rápido.
Otra característica a tener en cuenta es su inflamabilidad. Aunque no es tan inflamable como otros gases combustibles, el amoníaco puede arder o explotar en concentraciones altas (aproximadamente entre el 15% y el 28% en aire). Si se alcanza esa proporción en un ambiente cerrado y existe una fuente de ignición, puede ocurrir una combustión violenta.
Además, al descomponerse térmicamente, el amoníaco puede generar hidrógeno, que es altamente inflamable. En la práctica, los accidentes graves con amoníaco suelen estar relacionados más con inhalación tóxica que con incendios, pero el riesgo de fuego aumenta en presencia de calor extremo o chispas en zonas con amoníaco concentrado.

En el hogar, el amoníaco también representa peligros si se usa indebidamente. Un error común y muy peligroso es mezclar amoníaco con lavandina o lejía (hipoclorito de sodio). Esta combinación química produce cloraminas gaseosas sumamente tóxicas que causan irritación aguda de ojos y pulmones.
Por ello, nunca se deben mezclar productos de limpieza que contengan amoníaco con productos a base de cloro. En general, se recomienda utilizar el amoníaco doméstico en áreas bien ventiladas y mantenerlo fuera del alcance de niños, ya que su ingesta también puede causar quemaduras internas graves.
Resumiendo, el amoníaco requiere precaución extrema en su manejo: es obligatorio el uso de protección personal en entornos laborales, disponer de sistemas de detección de fugas y planes de contingencia, y seguir buenas prácticas de almacenamiento y transporte (tanques adecuados, válvulas de seguridad, rotulación de peligro, etc.). Con las medidas de seguridad apropiadas, los accidentes pueden minimizarse, pero nunca debe subestimarse la peligrosidad intrínseca de este compuesto.
Impacto ambiental del amoníaco
El amoníaco, a pesar de no ser un gas de efecto invernadero directo, tiene diversos impactos negativos en el medio ambiente cuando se libera o cuando sus derivados (como los fertilizantes) no se gestionan adecuadamente. Uno de los principales problemas ambientales asociados es la contaminación del agua y su contribución a la eutrofización. Cuando se aplican fertilizantes a base de amoníaco (urea, nitratos de amonio, etc.) en exceso o en el momento inadecuado, las plantas no absorben todo el nitrógeno.
La lluvia puede arrastrar el amoníaco, el ion amonio (NH4+) y los nitratos resultantes hacia ríos, lagos y acuíferos. Este exceso de nutrientes en cuerpos de agua promueve un crecimiento desmesurado de algas y plantas acuáticas (particularmente algas microscópicas), fenómeno conocido como eutrofización.
A corto plazo puede parecer un “florecimiento” de vida, pero al morir esa biomasa vegetal y descomponerse, consume gran parte del oxígeno disuelto en el agua, generando zonas muertas donde peces y otros organismos no pueden sobrevivir por falta de oxígeno. La eutrofización ocasiona graves desequilibrios en los ecosistemas acuáticos, malos olores, turbidez y hasta la producción de toxinas algales que afectan la calidad del agua potable.
Además, la liberación de amoníaco al ambiente puede afectar la calidad del aire. En zonas con ganadería intensiva (donde abundan desechos animales ricos en urea que se transforma en amoníaco) o cerca de fábricas de fertilizantes, las emisiones de NH3 al aire contribuyen a la formación de partículas finas contaminantes.
El amoníaco en la atmósfera reacciona con otros contaminantes ácidos, como los óxidos de azufre (SOX) y los óxidos de nitrógeno (NOX), dando lugar a sales de amonio (sulfato de amonio, nitrato de amonio) que forman parte del material particulado PM2.5.Estas partículas pueden ser transportadas por el viento a largas distancias, degradando la calidad del aire regional.
Una alta concentración de partículas PM2.5 es nociva para la salud humana, ya que penetra profundamente en los pulmones. Por lo tanto, aunque el amoníaco en sí no es un contaminante regulado como gas de efecto invernadero, sí actúa como precursor de contaminación atmosférica en forma de aerosoles secundarios.
En cuanto al impacto climático, el amoníaco juega un papel indirecto. Por un lado, el uso masivo de fertilizantes nitrogenados ha aumentado las emisiones de óxido nitroso (N2O), un gas de efecto invernadero potentísimo (unas 300 veces más potente que el CO2 en su efecto de calentamiento global).
El N2O se genera como subproducto microbiano cuando el exceso de nitrógeno de fertilizantes en el suelo es transformado por bacterias (en procesos de nitrificación y desnitrificación). Así, el ciclo del nitrógeno impulsado por el amoníaco agrícola contribuye al cambio climático a través del N2O.
Por otro lado, la propia fabricación industrial de amoníaco ha tenido un costo ambiental en términos de emisiones de CO2. Como se mencionó, la mayoría de plantas de amoníaco usan gas natural o carbón como fuente de energía e hidrógeno, liberando CO2 en el proceso. Se estima que la producción de amoníaco es responsable de casi un 2% de la demanda energética mundial y una proporción similar de las emisiones globales de dióxido de carbono.
Esto significa que tradicionalmente, por cada tonelada de amoníaco fabricada, se emiten varias toneladas de CO2 a la atmósfera (aunque parte de ese CO2 luego se reutiliza para fabricar urea, mitigando ligeramente el impacto). La transición hacia métodos de producción con hidrógeno verde busca eliminar estas emisiones.
En resumen, el amoníaco tiene un impacto ambiental notable si no se controla su ciclo de vida. Puede contaminar aguas y suelos, contribuir a la contaminación del aire y agregar gases de efecto invernadero de forma indirecta. Para minimizar estos efectos, se promueve el uso eficiente y equilibrado de fertilizantes (evitando excesos), la captura y tratamiento de emisiones en granjas industriales, y la investigación en procesos de producción de amoníaco más limpios.
El desafío en adelante es mantener los beneficios del amoníaco para la sociedad (en producción de alimentos y otros bienes) a la par que se reducen y mitigan los daños ambientales asociados.
¿Te interesan las noticias?
En Iceebook también analizamos noticias científicas, ambientales y tecnológicas. Descubre lo que está ocurriendo ahora en las categorías: Espacio, Ciencia, Planeta Tierra, Tecnología y El Mundo.
Visita nuestra sección de noticias →Preguntas frecuentes
- 💬 El amoníaco es un gas incoloro compuesto por nitrógeno e hidrógeno, utilizado principalmente en la fabricación de fertilizantes y como refrigerante industrial.
- 💬 El amoníaco se produce principalmente mediante el proceso Haber-Bosch, que combina nitrógeno e hidrógeno a alta presión y temperatura.
- 💬 El amoníaco se utiliza en la producción de fertilizantes, productos de limpieza, refrigeración industrial, y como materia prima en la industria química.
- 💬 La exposición al amoníaco puede causar daños respiratorios graves, irritación ocular, y quemaduras en la piel, siendo especialmente peligroso en concentraciones altas.
 Iceebook Learn
Iceebook Learn






