¿Qué es el proceso Haber-Bosch?
El proceso Haber-Bosch es un método químico industrial que permite obtener amoníaco combinando directamente nitrógeno gaseoso e hidrógeno. Desarrollado a principios del siglo XX, este proceso solucionó el problema de la “fijación del nitrógeno”, es decir, la dificultad de convertir el nitrógeno inerte de la atmósfera en compuestos utilizables por las plantas.
En otras palabras, el proceso Haber-Bosch toma el nitrógeno del aire (que constituye aproximadamente el 78% de la atmósfera) y lo “fija” en forma de amoníaco, un compuesto nitrogenado accesible para usos agrícolas e industriales.
En el ámbito práctico, el proceso Haber-Bosch se lleva a cabo en reactores químicos a alta presión y temperatura. Es considerado uno de los avances más importantes de la química industrial, ya que antes de su invención las fuentes de nitrógeno para fertilizantes y otros productos (como el salitre natural o el guano) eran limitadas y no podían cubrir la demanda mundial.
Con Haber-Bosch, la producción de amoníaco dejó de depender de recursos naturales escasos y pasó a ser técnicamente ilimitada usando el aire como materia prima de nitrógeno.
¿Cómo funciona el proceso Haber-Bosch?
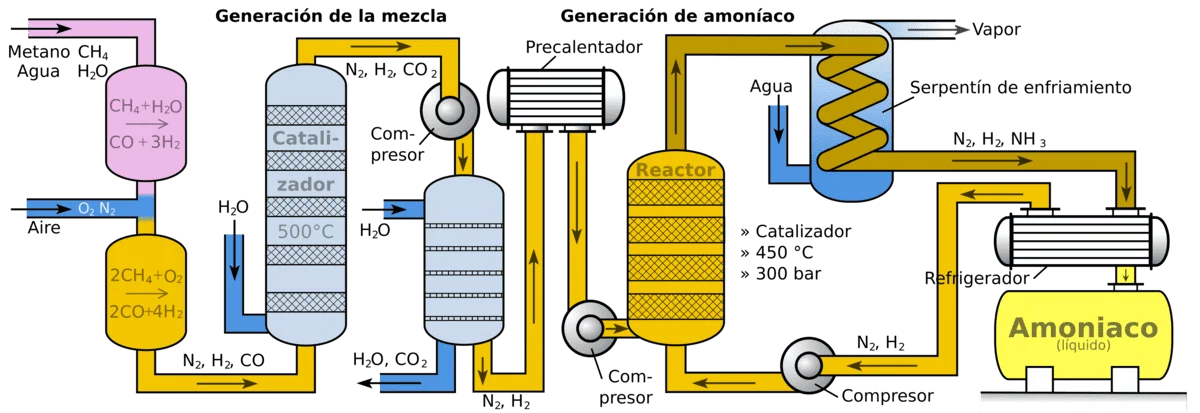
El proceso Haber-Bosch se basa en la siguiente reacción química: N2 + 3 H2 → 2 NH3.

En condiciones normales, el nitrógeno (N2) es un gas muy estable y no reacciona fácilmente con el hidrógeno (H2). Para forzar esta reacción, el proceso emplea altas presiones y temperaturas, junto con un catalizador adecuado:
- Presión elevada: se trabaja típicamente a presiones del orden de 150–200 atmósferas. La alta presión favorece que las moléculas de nitrógeno e hidrógeno se aproximen y reaccionen para formar amoníaco.
- Temperatura alta: alrededor de 400–500 °C. A estas temperaturas, la reacción ocurre a una velocidad suficientemente rápida. Aunque la formación de amoníaco es exotérmica (libera calor), temperaturas elevadas son necesarias para vencer la inercia inicial del N2, que tiene un enlace molecular muy fuerte.
- Catalizador: se utiliza un catalizador heterogéneo (generalmente a base de hierro con promotores como potasio y aluminio) que acelera la reacción sin consumirse. El catalizador ayuda a debilitar el enlace triple del nitrógeno y facilita su combinación con el hidrógeno.
En una planta Haber-Bosch, se hace circular una mezcla de gases de nitrógeno e hidrógeno sobre el catalizador en un reactor. Gran parte del nitrógeno e hidrógeno no reaccionan en un solo paso, por lo que el proceso es cíclico: los gases no convertidos se reciclan continuamente a la entrada del reactor tras separar el amoníaco producido.
De este modo, se logra una conversión gradual hasta obtener un rendimiento elevado. El amoníaco resultante sale en forma gaseosa del reactor y luego se enfría y licúa (se convierte en líquido) para ser almacenado o procesado.
Un aspecto clave es la obtención de las materias primas gaseosas. El nitrógeno se obtiene fácilmente del aire mediante separación de gases (ya que el aire es ~78% N2). El hidrógeno, por su parte, proviene en la actualidad principalmente del gas natural. A través del reformado del metano (CH4) presente en el gas natural con vapor de agua, se genera hidrógeno y dióxido de carbono como subproducto. Este hidrógeno alimenta el proceso Haber-Bosch.
En resumen, el proceso funciona creando un entorno donde el nitrógeno e hidrógeno pueden reaccionar eficientemente: altas presiones acercan las moléculas, altas temperaturas incrementan la energía cinética para superar la barrera de reacción, y el catalizador proporciona una ruta de reacción más fácil. El resultado final es la síntesis continua de amoníaco a escala industrial.
¿Para qué se utiliza el proceso Haber-Bosch?
El amoníaco producido mediante el proceso Haber-Bosch tiene numerosos usos, pero su destino principal es la fabricación de fertilizantes nitrogenados. A continuación, se destacan los usos más importantes del amoníaco generado por Haber-Bosch:
- Producción de fertilizantes agrícolas: Cerca del 80–90% del amoníaco mundial se emplea para sintetizar fertilizantes químicos. Entre ellos están el nitrato de amonio (NH4NO3), la urea (CO(NH2)2) y otros compuestos nitrogenados que se aplican a los suelos para mejorar la productividad de los cultivos. Estos fertilizantes proveen nitrógeno asimilable por las plantas, lo que aumenta significativamente los rendimientos agrícolas.
- Fabricación de explosivos: El amoníaco es también un precursor en la industria de explosivos. A través del proceso de nitración, el amoníaco puede convertirse en ácido nítrico (HNO3), que a su vez se usa para producir nitratos explosivos como la nitroglicerina, el TNT y el mismo nitrato de amonio (que, además de fertilizante, es un explosivo oxidante). Históricamente, durante la Primera Guerra Mundial, el proceso Haber-Bosch fue crucial para que potencias como Alemania obtuvieran explosivos pese a la escasez de nitratos naturales.
- Uso industrial general: El amoníaco en sí mismo se utiliza en varios procesos industriales. Por ejemplo, es un gas refrigerante común en sistemas de refrigeración industrial y plantas de hielo. También se emplea en la producción de fibras sintéticas (como el nailon) y plásticos, en productos de limpieza (soluciones de amoníaco) e incluso en la industria farmacéutica. Aunque estos usos representan un porcentaje menor comparado con los fertilizantes, siguen siendo importantes en la economía industrial.

En síntesis, el proceso Haber-Bosch se utiliza sobre todo para sustentar la agricultura moderna a través de fertilizantes. Gracias a estos fertilizantes sintéticos, se puede reponer el nitrógeno en los suelos de cultivo y mantener altas producciones de alimentos. Adicionalmente, el amoníaco proveniente de Haber-Bosch nutre a varias industrias (desde la minería hasta la refrigeración), lo que demuestra su versatilidad.
Importancia del proceso Haber-Bosch
El impacto del proceso Haber-Bosch en la sociedad y el planeta ha sido enorme, al punto de ser considerado uno de los inventos más importantes del siglo XX. Su importancia se manifiesta en varios aspectos:
- Revolución agrícola y aumento de la producción de alimentos: Antes de Haber-Bosch, la disponibilidad de nitrógeno para la fertilización era un factor limitante para la agricultura. Con la síntesis industrial de amoníaco, la producción de fertilizantes se disparó. Esto permitió incrementar notablemente los rendimientos agrícolas y evitar hambrunas en gran escala. Se estima que una gran proporción de la población mundial actual (alrededor de la mitad) es alimentada gracias a cultivos fertilizados con nitrógeno de origen Haber-Bosch. Sin este proceso, la Tierra difícilmente podría sustentar a más de 8 mil millones de personas como lo hace hoy.
- Independencia de recursos naturales escasos: A inicios del siglo XX, las naciones dependían de yacimientos de nitratos naturales (como el salitre chileno) y de guano para obtener fertilizantes y pólvora. El proceso Haber-Bosch rompió esa dependencia, ya que cualquier país con acceso a aire, agua y una fuente de energía puede producir amoníaco. Esto democratizó el acceso a fertilizantes, reduciendo la presión geopolítica sobre las fuentes naturales de nitrógeno.
- Desarrollo de la industria química y avance científico: La implementación del proceso Haber-Bosch impulsó mejoras en ingeniería química, catalizadores y tecnologías de alta presión. Fue la base para otras síntesis químicas importantes a escala industrial. Además, reconoció el trabajo de sus creadores con Premios Nobel (Fritz Haber en 1918 y Carl Bosch en 1931), resaltando la trascendencia científica del logro.
En pocas palabras, Haber-Bosch sentó las bases de la agricultura moderna y la seguridad alimentaria global. Es gracias a este proceso que los fertilizantes nitrogenados se produjeron en cantidades suficientes para sostener el crecimiento poblacional del siglo XX y XXI.
Por ello, muchos historiadores y científicos lo describen como la invención que “extrajo pan del aire”, en alusión a cómo convirtió un gas atmosférico en sustento para la humanidad.
Impacto ambiental del proceso Haber-Bosch
Si bien el proceso Haber-Bosch ha traído enormes beneficios, también conlleva impactos ambientales significativos tanto en su fase de producción de amoníaco como en el uso de los fertilizantes resultantes. Los principales efectos ambientales asociados son:
- Elevadas emisiones de CO2: La síntesis de amoníaco consume cantidades masivas de energía. Habitualmente, esta energía proviene de la quema de combustibles fósiles (por ejemplo, el gas natural utilizado para obtener hidrógeno). En consecuencia, los complejos de producción de amoníaco liberan grandes emisiones de dióxido de carbono, contribuyendo al cambio climático. Se calcula que la fabricación de amoníaco representa aproximadamente un 1–2% del consumo energético global y una proporción similar de las emisiones mundiales de CO2.
- Contaminación del agua y suelos: El uso intensivo de fertilizantes nitrogenados tiene un lado negativo: cuando se aplica más nitrógeno del que las plantas pueden absorber, el excedente se filtra en el entorno. Los nitratos provenientes de fertilizantes llegan a las aguas subterráneas, ríos y lagos, causando eutrofización. La eutrofización es el crecimiento desmedido de algas y microorganismos acuáticos debido al exceso de nutrientes, lo que agota el oxígeno del agua y puede matar peces y otras formas de vida. Este fenómeno es una de las causas de la contaminación del agua en zonas agrícolas intensivas.
- Emisión de óxido nitroso (N2O): Parte del nitrógeno de los fertilizantes no termina en las cosechas sino que es transformado por bacterias en el suelo en óxido nitroso, un gas de efecto invernadero muy poderoso (unas 300 veces más potente que el CO2) y que además contribuye a la destrucción de la capa de ozono. Las actividades agrícolas enriquecidas con fertilizantes sintéticos han aumentado las concentraciones de N2O en la atmósfera, agravando el calentamiento global.
- Consumo de recursos no renovables: Haber-Bosch depende del suministro de hidrógeno, que hoy por hoy se obtiene casi totalmente de combustibles fósiles (gas natural, carbón). Esto implica extraer y consumir recursos finitos, generando impactos asociados a la obtención de estos combustibles, como las emisiones fugitivas de metano o la degradación de ecosistemas por la minería de carbón.

Estos problemas han motivado esfuerzos por mitigar el impacto ambiental del proceso Haber-Bosch y del uso de sus productos. En la industria química, se investigan alternativas para producir “amoniaco verde” utilizando hidrógeno obtenido por electrólisis del agua con energías renovables, eliminando así las emisiones de CO2 del proceso.
Asimismo, en la agricultura se promueve un uso más eficiente de los fertilizantes (dosificación adecuada, técnicas de agricultura de precisión) y el desarrollo de fertilizantes de liberación controlada para reducir las pérdidas de nitrógeno al medio ambiente.
Inventores y contexto histórico del proceso Haber-Bosch
El proceso lleva el nombre de sus dos creadores: Fritz Haber y Carl Bosch. A comienzos del siglo XX, la comunidad científica buscaba desesperadamente una forma de “fijar” el nitrógeno del aire para producir compuestos útiles, dado el temor de que las fuentes naturales de nitrógeno no soportaran la demanda agrícola y industrial creciente.
Fritz Haber, un químico alemán, logró en 1909 por primera vez sintetizar amoníaco a partir de nitrógeno e hidrógeno en condiciones controladas de laboratorio. Haber desarrolló un pequeño reactor de alta presión y descubrió que utilizando ciertos catalizadores (inicialmente osmio y uranio) podía obtener trazas de amoníaco. Este experimento pionero demostró la viabilidad química del proceso, aunque aún no era práctico para producción a gran escala.
Carl Bosch, ingeniero químico alemán que trabajaba para la empresa BASF, tomó el logro de Haber y lo convirtió en una realidad industrial. Entre 1909 y 1913, Bosch lideró el esfuerzo de ingeniería para construir reactores de gran tamaño capaces de soportar presiones y temperaturas extremas de forma continua.
Esto implicó resolver numerosos desafíos: desarrollar recipientes de acero resistentes a la corrosión y la presión, diseñar sistemas de enfriamiento y reciclaje de gases, y encontrar un catalizador barato y efectivo (finalmente se empleó hierro con promotores, más accesible que el osmio). En 1913 entró en operación la primera planta industrial de amoníaco en Oppau (Alemania), propiedad de BASF, marcando el inicio de la era del Haber-Bosch a escala mundial.

El éxito del proceso Haber-Bosch tuvo implicaciones inmediatas. Durante la Primera Guerra Mundial (1914–1918), Alemania pudo producir explosivos y fertilizantes independizándose del salitre importado, lo que extendió su capacidad bélica. Irónicamente, Fritz Haber también participó en el desarrollo de armas químicas durante la guerra, lo que le valió fama controvertida: es recordado tanto como el “padre de la guerra química” como por ser el científico que posibilitó alimentar a millones de personas.
Por su parte, Carl Bosch continuó innovando en el campo de la química industrial (desarrolló procesos de síntesis de metanol y otros) y llegó a dirigir IG Farben, uno de los mayores conglomerados químicos de la época.
En reconocimiento a la importancia del proceso, Fritz Haber recibió el Premio Nobel de Química en 1918 por la síntesis del amoníaco, y Carl Bosch compartió el Premio Nobel de Química en 1931 por sus contribuciones a la ingeniería química de altas presiones y la implementación industrial de procesos como el de Haber-Bosch. El legado histórico de ambos inventores es complejo pero innegablemente ligado a un avance científico que transformó al mundo.







